Hay distintos tipos de configuraciones electrónicas y según la configuración electrónica se puede saber de que elemento se trata y sus propiedades. La configuración electrónica se define como la disposición de los electrones en sus orbitales atómicos correspondientes.
¿Cómo se colocan de forma correcta los electrones en los orbitales?
Para poder colocar los electrones en la configuración electrónica de forma correcta y sabiendo lo que se hace hay que conocer algunos principios y reglas.
Nivel energético (n).
El nivel energético es la capa en la que se sitúan los electrones, es decir, dos electrones con el mismo número cuántico principal tienen el mismo nivel energético.
Subnivel energético (l).
El subnivel energético es el tipo de orbital en el que se sitúa un electrón (s, p, d, ó f).
Principio de exclusión de Pauli para la configuración electrónica.
En un átomo no pueden existir dos electrones con los mismos números cuánticos.
Lo que quiere decir este principio es que en un orbital solo caben dos electrones, ya que el número cuántico de spin, que es el que varía si estamos en un orbital ya definido, es el único que puede variar. Un electrón va a tener cono números cuánticos (1, 0, 0, 1/2) y el otro (1, 0, 0, -1/2).
Regla de máxima multiplicidad de Hund.
Los electrones se colocan ocupando los orbitales vacíos de menor energía con el mismo spin hasta que el subnivel esté completo.
Esta regla quiere decir que si estamos en el subnivel 2p, que tiene tres orbitales, los primeros tres electrones se van a colocar uno en cada orbital con el mismo spin y luego se colocan los demás hasta que estén todos llenos (recuerda que el principio de exclusión de Pauli nos prohíbe que haya más de dos electrones en cada orbital).
Principio de mínima energía.
Los electrones se sitúan en el orbital disponible de mínima energía.
Esto depende de la energía de cada orbital, pero para eso necesitamos el diagrama de Moeller.
Diagrama de Moeller y regla de Madelung.
La energía de cada orbital depende del subnivel en el que estén situados, es decir, de los números cuánticos n y l. La regla de Madelung nos permite comparar la energía de los orbitales. Esta regla dice:
A mayor valor de n+l mayor energía del subnivel, pero si dos orbitales tienen el mismo valor de n+l tiene mayor energía el subnivel de mayor n.
Si queremos comparar la energía de los subniveles 3p y 4s, lo primero es obtener los números cuánticos n y l de cada uno. Para el subnivel 3p tiene n=3 y l=1, mientras que el subnivel 4s tiene n=4 y l=0. Aplicando la regla de Madelung, el subnivel 4s tendría más energía, ya que la suma de n+l en los dos subniveles es la misma pero el número cuántico n en el subnivel 4s es mayor, por lo que tiene mayor energía.
El diagrama de Moeller se basa en la regla de Madelung para formar una imagen visual y más fácil de aprender para ver el orden de los subniveles según su energía.

Si utilizamos el diagrama de Moeller podemos definir el siguiente orden:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f …
Tipos de configuraciones electrónicas.
Ahora que se han explicado estas reglas básicas se puede pasar a los tipos de configuraciones electrónicas.
Configuración electrónica estándar completa.
Este tipo de configuración electrónica es la más sencilla y la más común. En ella se escriben todos los niveles y subniveles de energía, junto con el número de electrones que hay en cada orbital. Lo mejor es ver un ejemplo:
Escribir la configuración electrónica del cloro (Z=17) y del rubidio (Z=37).
Cloro: este elemento tiene como número atómico 17, por lo que, como el elemento es neutro, tendrá 17 electrones. Estos 17 electrones se tienen que colocar según las reglas y principios explicados arriba.
Siguiendo el orden del diagrama de Moeller colocamos el primer subnivel de energía.
Cl: 1s
Según el principio de exclusión de Pauli solo caben 2 electrones en cada orbital, por lo que en el subnivel s al tener solo un orbital, solo caben dos electrones. Se escribe un dos como un exponente de la s para señalar que ese orbital ya tiene 2 electrones. Como ya está lleno colocamos el siguiente subnivel, el 2s.
Cl: 1s2 2s
Según el principio de exclusión de Pauli en este subnivel también caben solo 2 electrones. Se colocan y se escribe el siguiente subnivel con su correspondiente exponente.
Cl: 1s2 2s2 2p2
Se siguen añadiendo electrones hasta colocar los 17 que tiene el elemento.
Cl: 1s2 2s2 2p6 3s2 3p5
Esta sería la configuración electrónica estándar completa para el cloro.
Rubidio: este elemento tiene como número atómico 37, por lo que, como el elemento es neutro, tendrá 37 electrones. Estos 37 electrones se tienen que colocar según las reglas y principios explicados arriba. Como en el anterior ejemplo se completa la configuración electrónica hasta obtener esta:
Rb: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1
Configuración electrónica estándar abreviada.
Para escribir esta configuración estándar en su forma abreviada se escribe el gas noble que precede al elemento en la tabla periódica entre corchetes y el último nivel de la configuración. Las configuraciones abreviadas de cloro y rubidio son:
Cl: [Ne] 3s2 3p5
Rb: [Kr] 5s1
Configuración electrónica de cajas.
La configuración electrónica de cajas es una forma menos utilizada que las dos anteriores pero muy útil si queremos manipular los electrones dentro de la configuración electrónica. Esta forma nos sirve para ver los electrones perfectamente.
En la configuración electrónica de cajas se relacionan los orbitales con cajas y los electrones con flechas. Si la flecha está hacia arriba significa que su spin es positivo. Por el contrario, el electrón tendrá spin negativo cuando la flecha esté hacia abajo.
Si queremos obtener la configuración electrónica de cajas del cloro dibujamos los orbitales que sean necesarios para rellenar 17 electrones. Como en cada orbital caben 2 orbitales necesitaremos un total de 9 orbitales. Este número se obtiene al dividir el número de electrones entre dos.
Los subniveles de tipo s tienen un solo orbital, los de tipo p tienen tres orbitales, los de tipo d tienen cinco y los de tipo f tienen 7 orbitales. Teniendo en cuenta el diagrama de Moeller (da el orden de energía de los orbitales) se dibujan tantas cajas como orbitales se necesiten, en este caso 9.
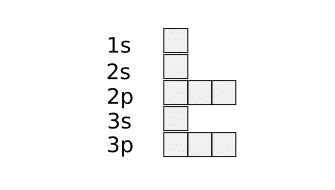
Una vez colocadas las cajas hay que colocar los electrones. Los dos primeros electrones se colocan en la caja 1s y los dos siguientes en la caja 2s.
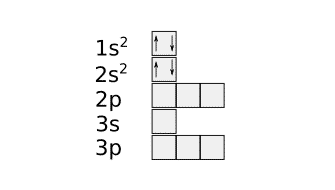
Después se empieza a colocar los electrones de los tres orbitales/cajas 2p. Para colocar estos electrones primero se coloca uno en cada caja con el mismo sentido de la flecha y cuando todas las cajas tengan una flecha se rellenan con flechas hacia abajo.
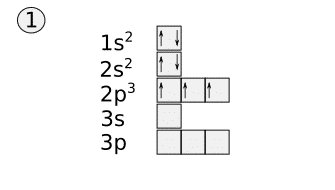
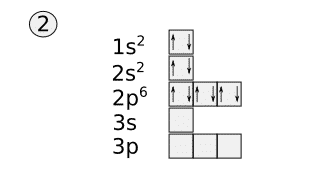
Tras esto se rellenan las cajas de la misma forma hasta que no queden electrones. Esta sería la configuración electrónica de cajas del cloro.

Al tener los tres orbitales 3p la misma energía los electrones se pueden colocar también de cualquiera de estas formas:
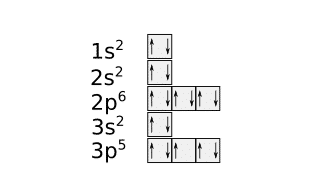

Conceptos derivados de la configuraciones electrónica.
Capa de valencia.
La capa de valencia es el último nivel de energía en el que se han colocado electrones. Los electrones de valencia son aquellos que están en la capa de valencia.
La configuración electrónica del cloro es: 1s2 2s2 2p6 3s2 3p5. La capa de valencia del cloro sería 3s2 3p5. El cloro tiene 7 e– de valencia.
Electrón diferenciador.
El electrón diferenciador es el último que se coloca en la configuración electrónica.
Elementos isoelectrónicos.
Dos elementos son isoelectrónicos cuando tienen el mismo número de electrones.
Iones e isótopos.
Los iones se obtienen cuando a un elemento neutro se le altera el número de electrones. Si el ion es positivo se denomina catión y si es negativo anión. Los aniones se obtienen al aumentar el número de electrones en un elemento, mientras que los cationes se obtienen al quitárselos.
Los isótopos se obtienen cuando a un elemento se le altera el número de neutrones.
La tabla periódica actual.
La tabla periódica actual fue diseñada por Meyer y Mendeleiev. El diseño se basaba en la agrupación de los elementos según sus propiedades químicas. Esta tabla tenía huecos que se decía en aquel entonces (con bastante acierto), que serían rellenados por elementos aún sin descubrir.
Tras años de desarrollo se concluyó que lo que dotaba a los elementos de sus propiedades químicas era, en su gran mayoría, debido a la configuración electrónica de estos elementos.
La tabla periódica está distribuida en 18 grupos (columnas) y 7 periodos (filas). Los elementos del mismo grupo tienen propiedades químicas semejantes. Los elementos están ordenados según su número atómico desde el elemento con Z=1, el hidrógeno, hasta elementos muy masivos que se desintegran en décimas de segundo por tener tantas partículas en su núcleo.
Grupos de la tabla periódica.
Hay determinados grupos de la tabla periódica a los que se les ha dado nombre propio. Los más importantes son los siguientes.
- Alcalinos: grupo 1.
- Alcalinotérreos: grupo 2.
- Térreos: grupo 13.
- Carbonoideos: grupo 14.
- Nitrogenoideos: grupo 15.
- Anfígenos: grupo 16.
- Halógenos: grupo 17.
- Gases nobles: grupo 18.
¿Cómo saber de que elemento se trata solo con su configuración electrónica?
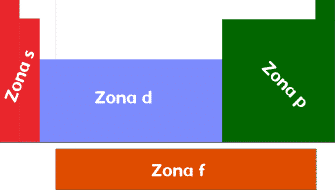
Si se tiene la configuración electrónica de un elemento se puede saber de que elemento se trata solo con su capa de valencia. La tabla periódica se puede dividir en 4 zonas según su capa de valencia como se ve en la siguiente imagen.
Zona s.
La zona s está compuesta por los elementos de los grupos 1 y 2, llamados alcalinos y alcalinotérreos respectivamente. Todos los elementos de esta zona terminan su configuración electrónica en un orbital de tipo s.
La capa de valencia de la configuración electrónica de un elemento situado en la zona s será:
nsm
La letra n puede tener valores del 1 al 7 y simboliza el periodo en el que se encuentra el elemento y la letra m puede tener los valores de 1 y 2 y nos indica el grupo. De esta forma el Ca (calcio) tendrá en la capa de valencia 4s2, por lo que su configuración electrónica es 1s2 2s2 2p6 3s2 3p6 4s2. Esto se debe a que está situado en el periodo 4, grupo 2.
Si, por el contrario, se tiene la configuración electrónica de un elemento A: 1s2 2s1 se puede saber que al tener una capa de valencia con n=2 y m=1 se trata del elemento que está situado en el periodo 2, grupo 1, es decir, el Na (sodio).
Zona p.
La zona p está compuesta por los elementos de los grupos 13, 14, 15, 16, 17 y 18. Todos los elementos de esta zona terminan su configuración electrónica en un orbital de tipo p.
La capa de valencia de la configuración electrónica de un elemento situado en la zona p será:
ns2 npm
La letra n puede tener valores del 1 al 7 y simboliza el periodo en el que se encuentra el elemento y la letra m puede tener los valores del 1 al 6 y al sumarle 12 nos indica el grupo del elemento. De esta forma el S (azufre) tendrá en la capa de valencia 3s2 3p4 por lo que su configuración electrónica es 1s2 2s2 2p6 3s2 3p4. Esto se debe a que está situado en el periodo 3, grupo 4+12=16.
Si, por el contrario, se tiene la configuración electrónica de un elemento B: 1s2 2s2 2p3 se puede saber que al tener una capa de valencia con n=2 y m=3 se trata del elemento que está situado en el periodo 2, grupo 15, es decir, el N (nitrógeno).
Zona d.
La zona d está formada por los llamados metales de transición. Todos los elementos de esta zona terminan su configuración electrónica en un orbital de tipo d.
La capa de valencia de la configuración electrónica de un elemento situado en la zona p será:
ns2 np6 ndm
La letra n puede tener valores del 1 al 7 y al sumarle 1 simboliza el periodo en el que se encuentra el elemento y la letra m puede tener los valores del 1 al 10 y al sumarle 2 nos indica el grupo del elemento. De esta forma el Cr (cromo) tendrá en la capa de valencia 3s2 3p6 3d4 por lo que su configuración electrónica es 1s2 2s2 2p6 3s2 3p6 4s2 3d4. Esto se debe a que está situado en el periodo 3+1=4 (porque n=3), grupo 4+2=6 (porque m=4).
Si, por el contrario, se tiene la configuración electrónica de un elemento C: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d9 se puede saber que al tener una capa de valencia con n=4 y m=9 se trata del elemento que está situado en el periodo 4+1=5, grupo 9+2=11, es decir, la Ag (plata).
Zona f.
La zona f está formada por los lantánidos y los actínidos, también llamados elementos de transición interna. Todos los elementos de esta zona terminan su configuración electrónica en un orbital de tipo f.
La capa de valencia de la configuración electrónica de un elemento situado en la zona p será:
ns2 np6 nd10 nfm
La letra n puede tener valores del 1 al 7 y al sumarle 2 simboliza el periodo en el que se encuentra el elemento y la letra m puede tener los valores del 1 al 14. Los metales de transición interna no tienen grupo.