En la actualidad se está desarrollando el modelo mecano cuántico. Este modelo es el modelo teórico más probado de la historia de la ciencia y resuelve con solvencia la mayoría de problemas que se le plantean.
Es un modelo con el que te puede estallar la cabeza hasta el punto que se dice que lo has entendido cuando dejas de entenderlo. Te recomiendo que leas el libro Desayuno con partículas uno de los libros que más me marcó cuando empecé a interesarme por este tema.
Inicios del modelo mecano cuántico.
Tras haber estudiado la hipótesis de Planck y el efecto fotoeléctrico empiezas a estudiar una de las dos grandes teorías que explican el comportamiento del mundo que conocemos.
Cuando Albert Einstein define el comportamiento de la luz como dual, es decir, que la luz se comporta como una partícula en unos casos y como onda en otros, un físico francés se hizo la siguiente pregunta:
Dado que la luz tiene un comportamiento dual, ¿podrán tener las partículas como los electrones también este comportamiento?
Principio de De Broglie.
En 1924 Luis De Broglie expone, en su tesis doctoral que las partículas como los electrones también tenían comportamientos ondulatorios y por lo tanto se podía obtener su longitud de onda o su frecuencia.
De esta forma su hipótesis es la siguiente:
Toda partícula de masa «m» que se mueve con velocidad «v» lleva asociada una longitud de onda y una frecuencia que vienen dadas por:
![]()
![]()
En este momento, todos se echaron las manos a la cabeza, pero resultó tener razón en base al experimento de la doble ranura. Esta hipótesis transformó el mundo de la física más aún de lo que ya se estaba transformando.
Experimento de Young o de la doble ranura.
El experimento de la doble ranura fue uno de los muchos intentos de demostrar la naturaleza ondulatoria de la luz. El experimento consistía en iluminar una pared con dos aberturas iguales con un haz de luz y medir cuál era el resultado tras atravesarla. El resultado es un patrón de interferencia. Esto es como cuando en el mar, una ola se encuentra con una roca. Al encontrarse la ola con este obstáculo esta se divide en dos y se forman picos o crestas en las olas. Estos picos o crestas se forman como consecuencia de la unión de las dos olas hijas.
Si bajamos la persiana de nuestra habitación llegaremos a la misma conclusión. La luz que entra por cada agujero de la habitación se expande por toda la habitación gracias al fenómeno de la dispersión de una onda.
Experimento de Young o de la doble ranura con electrones.
Este experimento se realizó con electrones para demostrar la naturaleza dual de estos también y se obtuvo el mismo resultado.
Vamos ahora a realizar el experimento de la doble ranura con electrones pero añadiendo un detector que se coloca en las ranuras para medir por donde pasa cada partícula. Si se realiza este experimento, el resultado es lo contrario a lo que debería salir. Aquí los electrones se comportan como partículas.


Si nosotros lanzamos pelotas de tenis mojadas en pintura (partículas) a través de las ranuras de la pared hasta chocar con una sábana blanca lo que veríamos en la sábana después del experimento sería lo que aparece en la foto del resultado con detector. Por otro lado, la foto del resultado din detector es lo que se llama un patrón de interferencia, es decir, las zonas en las que hay más golpeos son aquellas que coinciden con los «picos o crestas» si el experimento fuera con olas.
Principio de incertidumbre de Heisenberg.
Una vez que se identificó que todas las partículas tenían comportamientos corpusculares y ondulatorios. Heisenberg, un físico Alemán, abrió la puerta a la actual física cuántico. En los inicios de la mecánica cuántica los resultados obtenidos eran deterministas, es decir, comportamiento de los objetos que se estudiaban era conocido.
En 1927, este físico enuncia el principio de incertidumbre. Este principio revolucionó el concepto que teníamos hasta ese momento y revolucionará tu mente a partir de ahora.
El producto de la incertidumbre en una medida de la posición por la incentidumbre en una medida del momento lineal debe ser mayor que la constante de Planck dicidida por 4![]() .
.
![]()
El significado físico de este principio es que no podemos medir la posición y la velocidad de una partícula con una precisión infinita.
Función de onda. Ecuación de Schrödinger.
El principio de incertidumbre derrumbaba la física que estaba construida hasta ese momento. Los físicos siempre habían creído que podrían desarrollar una teoría como la de Rutherford o la de Bohr. Una teoría que les dijera donde se encontraban los electrones los protones y neutrones dentro de un átomo pero esa idea se había desvanecido.
En 1926 Erdwin Schrödinger desarrolla una teoría matemática, denominada como mecánica ondulatoria, en la que la posición del electrón se describe gracias a una función de onda ![]() .
.
No te preocupes por la ecuación de Schrödinger que no la vas a tener que resolver, a no ser que estudies el Grado en Física, que la resolverás allí.
El cuadrado de esta función de onda es la probabilidad de encontrar la partícula para la que está definida en una región del espacio.
En este momento nace la mecánica cuántica y por lo tanto el modelo mecano-cuántico del átomo.
El gato de Schrödinger.
Ante la dificultad, por parte de algunos de sus colegas, para comprender su teoría Schrödinger les hace un experimento teórico.
Supongamos que tenemos un gato encerrado en una caja que tiene un mecanismo en el que se introduce una partícula subatómica. Dentro del mecanismo, la partícula tiene dos caminos. Si pasa por uno mata al gato y si pasa por el otro lo salva. Cuando termina de exponer el experimento pregunta: ¿cómo está el gato?
La respuesta es simple pero sorprendente. El gato está vivo y muerto. Sí, las dos opciones a la vez. Esto se debe a que la partícula al no ser «observada» por nada recorre todos los caminos posibles y mata y salva al gato al mismo tiempo esto se llama superposición cuántica. Cuando la partícula se observa es cuando se produce lo que se denomina colapso de la superposición, es decir, solo una opción de todas las que existen puede ser observada. Esto también explica el resultado obtenido en el experimento de Young o de la doble ranura.
Esto parece digno de una película de MARVEL ¿eh? Pues es verdad y ocurre constantemente. Esta teoría es el resultado de un montón de aportaciones de distintos científicos, como Bohr, Heisenberg, Schrödinger, Feynman, Einstein, etc y todavía está en desarrollo.
Modelo mecano cuántico.
Al surgir la mecánica cuántica, el concepto de átomo tuvo que ser rediseñado. Los electrones ya no podían tener una órbita fija como en los modelos de Bohr y Rutherford y su movimiento estaba descrito por la función de onda.
Concepto de orbital.
Como se había descubierto el principio de incertidumbre, ya no se podía determinar la posición del electrón con una precisión infinita, por lo que en este modelo el concepto de órbita fue sustituido por el de orbital.
- Órbita: curva que describe un cuerpo alrededor de otro en el espacio.
- Orbital: región del espacio donde la probabilidad de encontrar al electrón es muy alta.
Al resolver la ecuación de Schrödinger para un átomo resultó que solo se encontraban resultados validos cuándo introducíamos unos valores determinados en ciertas variables. Estos números son los que llamamos números cuánticos.
Significado de los números cuánticos en el modelo mecano-cuántico.
Los números cuánticos, son variables de la energía en la ecuación de Schrödinger que solo pueden tomar valores sencillos, es decir, números enteros.
- n: número cuántico principal. Toma valores naturales, es decir, 1, 2, 3, 4, 5, 6, 7… Nos dice la extensión del orbital atómico, es decir, lo grande que es.
- l: número cuántico secundario. Toma solo los valores desde
 hasta
hasta  y determina el tipo de orbital en el que sitúa el electrón y por lo tanto su forma.
y determina el tipo de orbital en el que sitúa el electrón y por lo tanto su forma. - m: número cuántico magnético. Toma solo los valores desde
 hasta
hasta  pasando por el 0 (
pasando por el 0 ( ). Indica en que orbital está el electrón y su orientación espacial.
). Indica en que orbital está el electrón y su orientación espacial. - s: número cuántico de spin. Toma solo los valores
 . Nos dice en que sentido gira sobre su eje el electrón.
. Nos dice en que sentido gira sobre su eje el electrón.
Orbitales atómicos.
Según los números cuánticos podemos tener un tipo de orbital u otro. Vamos a ver los tipos que existen.
- Tipo s (l=0): es un orbital esférico, por lo que la probabilidad de encontrar al electrón solo depende de la distancia al núcleo.

- Tipo p (l=1): son tres parejas de lóbulos (
 ,
,  y
y  ) y existen cuando n es igual o mayor que dos. Cada orbital recibe el nombre por su orientación espacial. El orbital
) y existen cuando n es igual o mayor que dos. Cada orbital recibe el nombre por su orientación espacial. El orbital  son dos lóbulos en la dirección del eje x, el
son dos lóbulos en la dirección del eje x, el  son dos lóbulos en el eje y, y el
son dos lóbulos en el eje y, y el  lo mismo pero en el eje z. Esto supone que si en cada orbital caben dos electrones en total puede haber seis electrones en los orbitales p.
lo mismo pero en el eje z. Esto supone que si en cada orbital caben dos electrones en total puede haber seis electrones en los orbitales p.
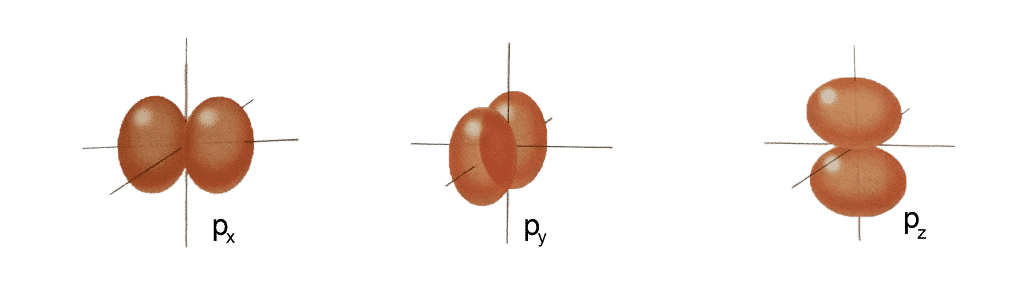
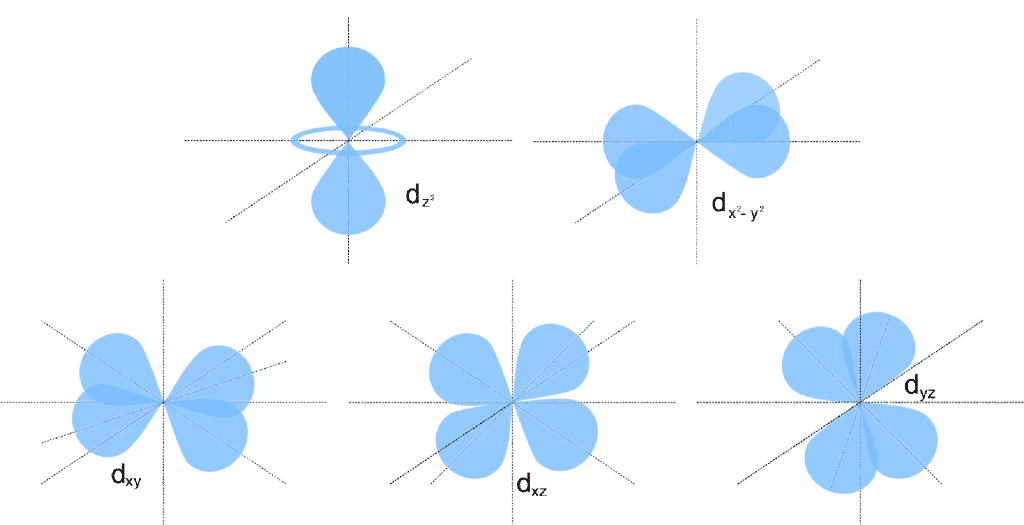
- Tipo d (l=2): aparecen cuando n es mayor o igual que tres, también está formados por lóbulos pero con una colocación más compleja. Estos orbitales son cinco (
 ,
,  ,
,  ,
,  y
y  ).
).
- Tipo f (l=3): aparecen cuando n es mayor o igual que cuatro y vuelven a estar formados por lóbulos con una disposición aún más compleja. Son siete (
 ,
,  ,
,  ,
,  ,
,  ,
,  y
y  ).
).
![]()



