Gracias a la tabla periódica se pueden comparar las propiedades de distintos elementos. Estas propiedades periódicas son:
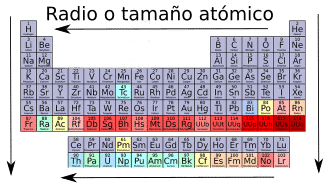
Radio o tamaño atómico.
Dentro de las propiedades periódicas, el radio atómico es una de las más sencillas de entender, dado que la mayoría de las personas son capaces de dibujar en su mente con mayor o menor precisión un átomo.
Definición.
El radio atómico se define como la distancia desde el centro del núcleo atómico hasta el electrón más externo de su capa de valencia.
Variación según su grupo y su periodo.
Comparación entre elementos neutros.
Cuando se compara el tamaño de dos elementos neutros del mismo grupo, el tamaño aumenta cuanto más abajo esté situado el elemento en la tabla periódica (aumenta hacia abajo). Esto se debe a que al bajar en el mismo grupo los orbitales se hacen mayores, por lo que el átomo aumenta en tamaño.
Cuando se compara el tamaño de dos elementos neutros del mismo periodo, el tamaño aumenta cuanto más hacia la izquierda esté el elemento en la tabla periódica (aumenta hacia la izquierda). Esto se debe a que en el mismo periodo los orbitales son del mismo tamaño, pero el número de protones en el núcleo aumenta, por lo que la fuerza que hace el núcleo hacia cada electrón es mayor.
Comparación entre iones.
Cuando hablamos de iones del mismo elemento, el ión negativo es de mayor tamaño que el ión positivo. Esto se debe a que si aumentamos el número de electrones produce un apantallamiento, haciendo que los electrones más externos no reciban tanta fuerza de atracción del núcleo.
El apantallamiento se produce cuando el número de electrones es elevado. Cuando los electrones se sitúan en el átomo aquellos situados en los primeros niveles de la configuración electrónica se disponen formando una barrera que produce que la fuerza eléctrica que une a los electrones más externos con el núcleo disminuya, haciendo que los electrones de la capa de valencia tengan mayor independencia del núcleo.
Ejercicio de ejemplo.
Considere los elementos cuyas configuraciones electrónicas son: ![]() ;
; ![]() . Justifique cual de estos elementos tiene mayor radio atómico.
. Justifique cual de estos elementos tiene mayor radio atómico.
Lo primero para resolver este ejercicio es saber la posición en la tabla periódica de estos elementos.
El elemento A está situado en el periodo 2, grupo 16 (anfígenos), por lo que es el carbono. El elemento B está situado en el periodo 2, grupo 2 (alcalinoterreos), por lo que es el berilio.
Tras encontrar su localización en la tabla periódica se escribe la definición de radio o tamaño atómico.
El radio atómico se define como la distancia desde el centro del núcleo atómico hasta el electrón más externo de su capa de valencia.
Una vez que está escrita la definición, escribimos y justificamos la variación en periodo. Esto se debe a que nos preguntan por dos elementos del mismo periodo.
Cuando se compara el tamaño de dos elementos neutros del mismo periodo, el tamaño aumenta cuanto más hacia la izquierda esté el elemento en la tabla periódica. Esto se debe a que en el mismo periodo los orbitales son del mismo tamaño, pero el número de protones en el núcleo aumenta, por lo que la fuerza que hace el núcleo hacia cada electrón es mayor.
Siguiendo el dibujo de la variación del radio o tamaño atómico se explica la conclusión (Este dibujo es una ayuda para aquellas personas a las que les cueste entender las justificaciones de la variación en grupo y periodo, se puede hacer sin el dibujo). El dibujo podemos ponerlo o no en el examen, es opcional.

Siguiendo con lo que se ha explicado anteriormente, el radio del elemento B es mayor que el del elemento A.
Se recomienda ver más ejercicios de propiedades periódicas en ejercicios resueltos (ARRIBA BOTÓN VERDE).
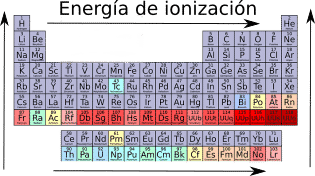
Energía de ionización.
Ya vimos una de las propiedades periódicas en el tema de estructura de la materia, la energía de ionización. Concretamente ya existe un ejercicio de cálculo de la energía de ionización en modelo de Bohr.
Definición.
La energía de ionización se define como la energía mínima necesaria que hay que suministrar a un átomo gaseoso en su estado fundamental para arrancarle un electrón.
Existen múltiples energías de ionización dependiendo del número de electrones que se le hayan arrancado antes. Existe la primera energía de ionización, la segunda (sería arrancarle el electrón después de ya haberle arrancado uno), la tercera…
![]()
![]()
Variación según su grupo y su periodo.
Comparación entre elementos neutros.
Cuando se compara la energía de ionización de elementos del mismo grupo, la energía de ionización aumenta cuanto más arriba esté el elemento en la tabla periódica (aumenta al subir). Esto se debe a que al subir en la tabla periódica el radio disminuye, por lo que el electrón que se pretende arrancar estará más cerca del núcleo haciendo que la atracción entre el núcleo y el electrón sea mayor.
Cuando se compara la energía de ionización de dos elementos del mismo periodo, la energía de ionización aumenta cuanto más hacia la derecha se encuentre el elemento en la tabla periódica (aumenta al ir hacia la derecha). Esto se debe a que al ir hacia la derecha en la tabla periódica disminuye el radio, por lo que el electrón que se pretende arrancar estará más cerca del núcleo haciendo que la atracción entre el núcleo y el electrón sea mayor.
Otra manera de justificar la energía de ionización.
La energía de ionización se puede justificar también con la estabilidad del átomo y el apantallamiento. Los átomos son estables al obtener la configuración electrónica del gas noble más cercano. Esto significa que al comparar dos elementos del mismo periodo, los elementos situados a la derecha de la tabla periódica tienen mayor energía de ionización, ya que al estar «tan cerca» de lograr la configuración electrónica del gas noble más cercano se van a «resistir» más a que le quitemos un electrón.
Por el contrario cuanto más a la izquierda estén en la tabla periódica más van a «querer» que les quiten un electrón, ya que su configuración electrónica va a estar mas cerca de la de un gas noble. Por otra parte, si comparamos dos elementos del mismo grupo, el apantallamiento provoca que al bajar en la tabla periódica los electrones estén más libres, haciendo que sea más fácil quitarles el electrón.
Comparación entre iones.
Cuando se tienen dos iones se tiene que analizar siguiendo la configuración electrónica de este elemento.
Por ejemplo, el O– solo necesita un electrón para llegar a tener la configuración electrónica más estable, la del gas noble más cercano. Esto nos dice que este ion va a tener una energía de ionización muy grande.
Por otro lado, si se tiene el Mg+, pasa justo lo contrario. La configuración electrónica de este ion solo necesita que se le quite un electrón para convertirse en la del gas noble más cercano, por lo que le va a «interesar mucho» que le quiten el electrón. Esto hace que la energía de ionización de este ion sea muy baja.
Si estamos en el caso para el que el elemento se ha ionizado obteniendo la configuración electrónica del gas noble más cercano, la energía de ionización va a ser muy alta. Ejemplos de esto último son el O2-, el Cl– o el Ca2+.
Comparación entre distintas energías de ionización del mismo elemento.
Con lo que se ha visto anteriormente se pueden analizar las distintas energías de ionización del mismo elemento. En este caso se va a analizar las energías de ionización del Ca. en el siguiente ejercicio.
Ejercicio de ejemplo con la energía de ionización.
Ordene de mayor a menor las tres primeras energías de ionización del Ca.
SoluciónLa primera energía de ionización de ionización se utilizaría para arrancarle al Ca su último electrón, la segunda para arrancarle el segundo y la tercera más de lo mismo. Las reacciones que se producirían son:
![]()
![]()
![]()
Lo primero es saber que la configuración electrónica del Ca es 1s2 2s2 2p6 3s2 3p6 4s2.
Si se elimina un electrón (transmitiéndole al Ca la EI1) terminaría en 4s1, por lo que esta energía de ionización sería baja, ya que se acerca a la configuración electrónica del gas noble más cercano.
Si al Ca+ se le elimina otro electrón (transmitiéndole al Ca+ la EI2) terminaría en 3p6, por lo que esta energía de ionización va a ser más baja que la anterior por haber conseguido la configuración electrónica del gas noble más cercano.
Por el contrario, al eliminar el tercer electrón (transmitiéndole la EI3) la energía de ionización va a ser enorme, ya que ahora tiene la configuración electrónica más estable posible.
Con este desarrollo se llega a la siguiente conclusión:
EI3>EI1>EI2
Se recomienda ver más ejercicios de propiedades periódicas en ejercicios resueltos (ARRIBA BOTÓN VERDE).
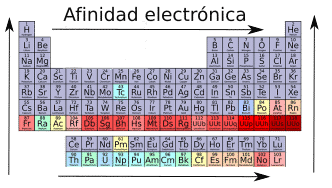
Afinidad electrónica.
Esta es otra de las propiedades periódicas relacionadas con la energía. Estas propiedades periódicas están relacionadas entre sí tanto en definición como en variación en la tabla periódica.
Definición.
La afinidad electrónica se define como la capacidad de un elemento de aceptar un electrón.
Variación según su grupo y su periodo.
Comparación entre elementos neutros.
Cuando se compara la afinidad electrónica de elementos del mismo grupo, esta aumenta cuanto más arriba esté el elemento en la tabla periódica (aumenta al subir). Esto se debe a que al subir en la tabla periódica el radio disminuye, por lo que el electrón que se pretende aportar estará más cerca del núcleo haciendo que la atracción entre el núcleo y el electrón sea mayor.
Los átomos son estables al obtener la configuración electrónica del gas noble más cercano. Esto significa que al comparar dos elementos del mismo periodo, los elementos situados a la derecha de la tabla periódica (aumenta hacia la derecha) tienen mayor afinidad electrónica, ya que al estar «tan cerca» de lograr la configuración electrónica del gas noble más cercano este va a estar «interesado» en aceptar un electrón para conseguirla. Por el contrario cuanto más a la izquierda esté en la tabla periódica menos le va a «interesar» que se le quite un electrón, ya que su configuración electrónica va a estar mas lejos de la de un gas noble.
Comparación entre iones.
Cuando comparamos dos o más iones tenemos que tener en cuenta la configuración electrónica para estos iones ya que la afinidad electrónica de los iones varía según su carga de forma parecida a la que lo hace la energía de ionización.
La afinidad electrónica en el caso de un ion como el S– va a ser muy alta dado que con un electrón más conseguiría la configuración electrónica del gas noble más cerano.
Por otro lado la afinidad electrónica del Na+ va a ser muy baja porque a este ion no le «interesa» aceptar un electrón, ya que aceptándolo dejaría de tener la configuración electrónica del gas noble más cercano.
Si estamos en el caso de un ion como el Mg+ su afinidad electrónica va a ser baja, pero no tanto como la del Na+. Esto es debido a que si al Mg+ se le añade un electrón tendría una configuración electrónica más alejada de la que debería tener para obtener su máxima estabilidad.
Ejercicio de ejemplo con la afinidad electrónica.
Considere un elemento X del grupo de los alcalinotérreos y un elemento Y del grupo de los
halógenos. Si X e Y se encuentran en el mismo periodo, ¿cuál tiene mayor afinidad electrónica?
Lo primero es escribir la definición de afinidad electrónica.
La afinidad electrónica se define como la capacidad de un elemento de aceptar un electrón.
Después explicamos la variación en el mismo periodo, ya que solo nos preguntar por dos elementos en el mismo periodo. Si estuvieran en periodos y grupos distintos tendríamos que explicar las dos.
Los átomos son estables al obtener la configuración electrónica del gas noble más cercano. Esto significa que al comparar dos elementos del mismo periodo, los elementos situados a la derecha de la tabla periódica tienen mayor afinidad electrónica, ya que al estar «tan cerca» de lograr la configuración electrónica del gas noble más cercano este va a estar «interesado» en aceptar un electrón para conseguirla.

Siguiendo la justificación anterior, el elemento Y, al estar en el grupo de los halógenos, tendrá mayor afinidad electrónica.
Se recomienda ver más ejercicios de propiedades periódicas en ejercicios resueltos (ARRIBA BOTÓN VERDE).
Electronegatividad.
Definición.
La electronegatividad se define como la tendencia de un elemento a atraer los electrones hacia su núcleo cuando está enlazado covalentemente con otro elemento.
Matemáticamente se puede extraer el valor de la electronegatividad haciendo la siguiente operación:
![]()
Variación según su grupo y su periodo.
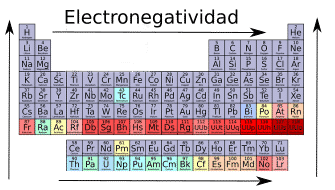
Cuando se compara la electronegatividad de elementos del mismo grupo, esta aumenta cuanto más arriba esté el elemento en la tabla periódica (aumenta al subir). Esto se debe a que cuanto más arriba esté el elemento mayor es la afinidad electrónica, es decir, más «querrá» los electrones, por lo que en un enlace covalente más acercará este elemento los electrones hacía sí mismo.
Cuando se compara la electronegatividad de elementos del mismo periodo, esta aumenta cuanto más hacia la derecha esté el elemento en la tabla periódica (aumenta hacia la derecha). Esto se debe a que cuanto más hacia la derecha esté, más cerca de los gases nobles está, por lo que con más fuerza «querrá» los electrones del enlace.
Ejercicio de ejemplo con electronegatividad.
Para cada uno de los elementos con la siguiente configuración electrónica en los
niveles de energía más externos: A=3s2 3p2 ; B= 3s2 3p5. Justifique cuál tendrá mayor electronegatividad.
La electronegatividad se define como la tendencia de un elemento a atraer los electrones hacia su núcleo cuando está enlazado covalentemente con otro elemento.
El elemento A y el elemento B están en el mismo periodo, por lo que se tiene que desarrollar la variación de la electronegatividad para elementos del mismo periodo.
Cuando se compara la electronegatividad de elementos del mismo periodo, esta aumenta cuanto más hacia la derecha esté el elemento en la tabla periódica. Esto se debe a que cuanto más hacia la derecha esté, más cerca de los gases nobles está, por lo que con más fuerza «querrá» los electrones del enlace.
El elemento A es del grupo 14 y el elemento B del 17. Esto implica que la electronegatividad del elemento B es mayor que la del elemento A.
Se recomienda ver más ejercicios de propiedades periódicas en ejercicios resueltos (ARRIBA BOTÓN VERDE).
Carácter metálico.
Definición.
El carácter metálico se define como la tendencia en los metales a ceder electrones.
Variación según su grupo y su periodo.
El carácter metálico varía en grupo y periodo de la misma forma que el radio.
Cuando se compara el carácter metálico de elementos del mismo grupo, este aumenta cuanto más abajo esté el elemento en la tabla periódica (aumenta hacia abajo). Esto se debe a que el radio también aumenta haciendo que la atracción de los electrones de la capa de valencia sea mayor y siendo más fácil que el elemento libere un electrón.
Cuando se compara el carácter metálico de dos elementos del mismo periodo, este aumenta cuanto más hacia la izquierda esté situado el elemento en la tabla periódica (aumenta hacia la izquierda). Esto se debe a que los elementos situados a la izquierda en la tabla periódica les «interesa» ceder electrones para obtener la configuración electrónica del gas noble más cercano.

Resumen de propiedades periódicas.
| Definición | Variación en el mismo grupo | Variación en el mismo periodo | |
| Radio | Distancia desde el centro del núcleo atómico hasta el electrón más externo de su capa de valencia. | Aumenta hacia abajo. | Aumenta hacia la izquierda. |
| Energía de ionización | Energía mínima necesaria que hay que suministrar a un átomo gaseoso en su estado fundamental para arrancarle un electrón. | Aumenta hacia arriba. | Aumenta hacia la derecha. |
| Afinidad electrónica | Capacidad de un elemento de aceptar un electrón. | Aumenta hacia arriba. | Aumenta hacia la derecha. |
| Electronegatividad | Tendencia de un elemento a atraer los electrones hacia su núcleo cuando está enlazado covalentemente con otro elemento. | Aumenta hacia arriba. | Aumenta hacia la derecha. |
| Carácter metálico | Tendencia en los metales a ceder electrones. | Aumenta hacia abajo. | Aumenta hacia la izquierda. |
![]()